
GloMax® Galaxy è un sistema di imaging in microscopia progettato per ottenere immagini di alta qualità sfruttando la bioluminescenza. L’avvento della luciferasi di nuova generazione NanoLuc®, capace di generare energia luminosa fino a 1000 volte più potente delle luciferasi tradizionali, ha infatti eliminato le limitazioni intrinseche alla bioluminescenza in ambito imaging, aprendo le porte ad una nuova era.
Per sfruttare appieno le potenzialità di questa nuova tecnologia, Promega ha sviluppato uno strumento di imaging espressamente dedicato alla bioluminescenza unico sul mercato, in grado di visualizzare e raccogliere immagini di altissima qualità da cellule e tessuti che esprimano Nanoluc® o tecnologie da essa derivate come ad esempio NanoBRET®, i sistemi di complementazione NanoBiT®, gli immunoassay della linea Lumit® e il sistema per la quantificazione dell’apoptosi RealTime-Glo™ Annexin V.
Grazie a queste nuove possibilità di imaging sarà quindi più semplice mettere a punto i propri saggi, ma anche ottenere risultati più completi che affianchino un dato qualitativo alle misurazioni quantitative ottenute dalle stesse applicazioni in saggi effettuati in piastra tramite i tradizionali lettori luminometrici.
Tra le principali applicazioni che possono beneficiare di questo nuovo approccio troviamo lo studio di:
- Interazioni proteina: proteina
- Localizzazione e traslocazione delle proteine
- Degradazione e stabilità delle proteine
- Interazioni ligando:proteina (target engagement)
- Uccisione cellulare mirata (targeted cell killing)
Visualizza proteine endogene a bassi livelli di espressione
La bioluminescenza consente l’imaging di proteine endogene la cui espressione fisiologica è molto bassa. Questo è possibile grazie ad alcune caratteristiche intrinseche della bioluminescenza, che non sono invece presenti nella fluorescenza. La principale è l’assenza di rumore di fondo. Quando si utilizza la fluorescenza infatti, è necessario immettere nel sistema energia luminosa atta ad eccitare il campione. Questa energia può generare effetti di autofluorescenza nel campione che stiamo analizzando, oppure filtrare nello spettro di acquisizione che stiamo utilizzando per raccogliere il segnale, dando origine a quello che viene definito come “background” o rumore di fondo. Se l’espressione del nostro reporter fluorescente è molto bassa, serviranno tempi di acquisizione più lunghi che andranno ad aumentare esponenzialmente questo problema. Inoltre, se stiamo lavorando con campioni vitali i lunghi tempi di acquisizione portano anche a problemi di fototossicità, perché l’energia utilizzata per eccitare il campione può avere ripercussioni sulle cellule che stiamo analizzando, generando artefatti. Senza contare come tempi lunghi di esposizione portino al fenomeno del photobleaching, ovvero alla distruzione del reporter con conseguente perdita di segnale nel tempo.
La bioluminescenza ovvia a queste limitazioni non avendo necessità di immettere energia nel sistema (originando il segnale non per eccitazione), ma tramite una reazione chimica di cui la luce è il prodotto finale. Questo vuol dire che tutta la luce prodotta è unicamente derivata dal nostro reporter, senza interferenze o artefatti, e che anche esposizioni più lunghe necessarie a visualizzare campioni poco abbondanti non hanno nessuna conseguenza sul campione e sul rapporto segnale:rumore del saggio. Grazie a queste caratteristiche è possibile osservare target con espressione molto bassa semplicemente aumentando il tempo di esposizione del campione.
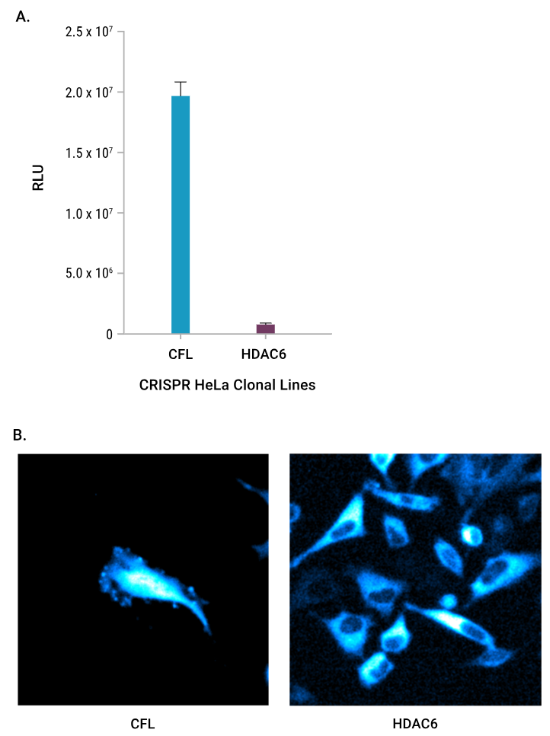
Imaging di proteine a bassa espressione mediante bioluminescenza
Figura A. Proteine endogene sono state marcate utilizzando il tag bioluminescente HiBiT tramite modifica del locus genomico via CRISPR/CAS9, in cellule HeLa. In analisi quantitative, le unità di luminescenza relativa (RLUs) delle due proteine mostrano un intervallo di 2 log nei segnali luminescenti tra proteine ad alta espressione (CFL) e a bassa espressione (HDAC6) endogene.
Figura B. Immagini delle stesse proteine ad alta e bassa espressione marcate con HiBiT® catturate con il GloMax® Galaxy. L’immagine della proteina CFL ad alta abbondanza ha richiesto un’esposizione di 1 minuto. L’immagine della proteina HDAC6 a bassa abbondanza ha richiesto un’esposizione di 3 minuti.
Monitorare la cinetica delle proteine nel tempo
Uno dei principali vantaggi dell’imaging bioluminescente è la stabilità e la sostenibilità intrinseca del segnale bioluminescente che, a differenza dei sistemi fluorescenti, non richiede eccitazione esterna. Questa assenza di eccitazione esterna riduce il rischio di fototossicità e fotobleaching, problemi comuni che possono influire negativamente sulla vitalità cellulare e sull’integrità del segnale nel tempo.
I marcatori bioluminescenti consentono sessioni di imaging ripetute nel corso di giorni, settimane o mesi senza alterare lo stato fisiologico del sistema in studio. Inoltre, i cambiamenti sottili nel segnale bioluminescente, che riflettono variazioni proteiche, sono più facilmente osservabili grazie ad un elevato rapporto segnale:rumore.
Un altro aspetto molto rilevante è la facilità di osservazione di dinamiche relative a proteine espresse a livelli fisiologici in sistemi cellulari vitali. Lavorando coi comuni sistemi in fluorescenza, i tag da utilizzare per la marcatura sono piuttosto grandi e complessi e rendono praticamente impossibile il loro utilizzo in operazioni di genome editing, a causa di una ridotta efficienza di knock-in. Per monitorare proteine endogene è quindi necessario utilizzare anticorpi, che non solo possono avere problemi di specificità, ma che non permettono la marcatura del target in un sistema cellulare vitale. Il tag bioluminescente HiBiT invece consta di soli 11 amminoacidi ed è perfetto per l’integrazione diretta nel locus del gene di interesse, permettendo knock-in ad alta efficienza tramite CRISPR/Cas9 e di conseguenza la visualizzazione della proteina anche in sistemi cellulari vitali.
Al fine di permettere esperimenti di live imaging anche molto prolungati nel tempo, Glomax® Galaxy Imager può essere equipaggiato con uno Stagetop Incubator/Controller che permette di mantenere le cellule in condizioni ideali per tutta la durata dell’esperimento, garantendo temperatura e concentrazione di CO2 ottimali.
Tutte queste caratteristiche sono ottimali, ad esempio, per lo studio della degradazione proteica mirata.
Degradazione proteica mirata nel tempo
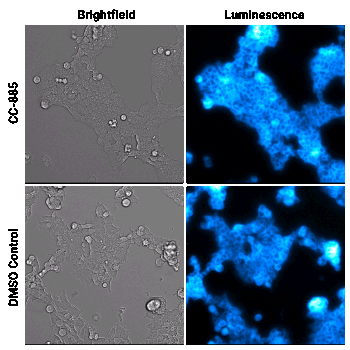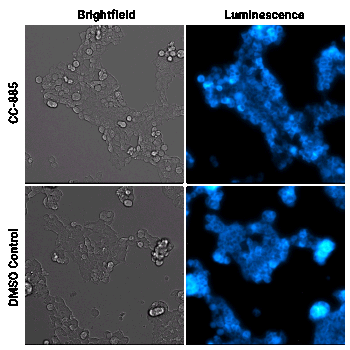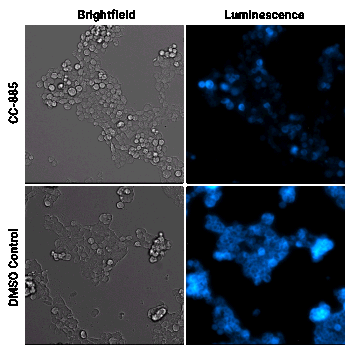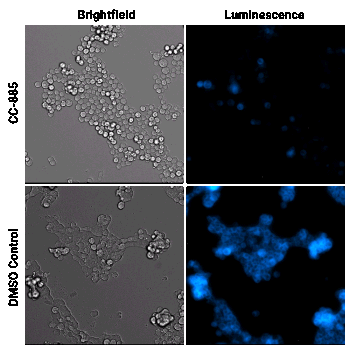
Cellule HEK293 che esprimono GSPT1 marcata tramite HiBiT sono state trattate con il composto degradatore CC-885 o con DMSO, come controllo. I campioni sono stati analizzati utilizzando il substrato per cellule vive Nano-Glo® Vivazine™ e sono stati osservati per 5 ore con il GloMax® Galaxy dotato di Stagetop Incubator/Controller.
Scopri di più sul GloMax® Galaxy Bioluminescence Imager





