
Da un recente articolo di Ympronta: Un eQMS che avrebbe voluto il padre del miracolo economico giapponese
“La qualità e i volumi di produzione sono incompatibili…se migliora la qualità diminuiscono i volumi, e viceversa. Di quanto possiamo ridurre la qualità senza perdere i clienti?”
Così inizia il celebre libro “Out of the crisis” di Edwards Deming, il padre del miracolo economico giapponese. Secondo Deming le affermazioni di questo genere sono il peggior malinteso che un manager o un imprenditore possa avere.
Un altro credo di Deming era che pretendere la qualità dagli operatori è inutile, chi deve garantire la qualità è il sistema. Noi conosciamo Deming per il ciclo “Plan-Do-Check-Act”, che dovrebbe essere alla base di qualunque sistema di qualità. Vediamo, dunque, quali dovrebbero essere le principali funzionalità di un moderno eQMS per l’industria farmaceutica.

SISTEMA DI QUALITÀ A CICLO CHIUSO
Come prima cosa decliniamo il ciclo di Deming sull’industria farmaceutica, riassumendo il percorso che compie il farmaco nel suo ciclo di vita:
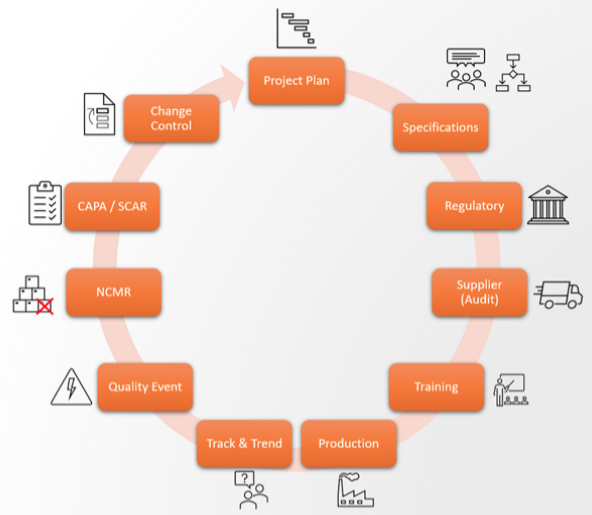
- Solitamente inizia tutto da un piano di progetto che riassume tutte le attività;
- Segue lo sviluppo delle specifiche del futuro processo/prodotto. Questa fase richiede molti input e iterazioni da parte di diversi attori;
- Approvate le specifiche, queste vengono inviate agli enti regolatori che ne determinano la conformità alle normative;
- Con le specifiche approvate alla mano si procede con la selezione e qualifica dei fornitori;
- Step successivo è training degli operatori, interni o esterni, che avranno il compito di fabbricare il medicinale;
- Finalmente si procede con la produzione dei lotti e a questo punto subentra il reparto Controllo Qualità;
- Inevitabilmente il monitoraggio della produzione e l’analisi dei lotti rilevano problemi, che vengono registrati come Eventi di Qualità;
- Gli eventi vengono analizzati, classificati e documentati sotto forma di NCMR (Non Conformity Material Report), Deviazioni o altre forme;
- Si identificano le CAPA (azioni correttive e preventive), SCAR (Supplier Corrective Action Request) che mirano a mitigare le conseguenze e/o ad eliminare le cause dei problemi rilevati e a migliorare i processi
- Se necessario, viene definito il documento di Change Control e si innesca nuovamente l’intero ciclo che deve essere dimensionato in base all’entità del cambiamento stesso.
La gestione della qualità a ciclo chiuso significa, essenzialmente, collegare il processo di qualità ai dati sulle prestazioni rilevati lungo l’intera catena del valore. L’obiettivo è sempre quello di migliorare la qualità, ma il monitoraggio da solo non basta, sono necessarie azioni concrete. La parola d’ordine è l’integrazione efficace tra tutti i processi, persone e sistemi aziendali per ottenere un circuito chiuso che si alimenta da solo.
COMPONENTI ESSENZIALI DEL EQMS
DOCUMENTAZIONE CONTROLLATA
Un documentale interno, piuttosto che un DMS esterno integrato, che permette di gestire i documenti lungo tutto il ciclo di vita (creazione, revisione, approvazione, lettura, archiviazione). L’eQMS deve assicurare la classificazione agevolata e sicura per tipo documento, reparto, progetto, fase, ruolo, persona, processo, etc. L’eQMS deve rendere l’esperienza utente più fluida possibile, e deve garantire la raccolta automatica dei metadati (audit trail, revisioni, versioni, etc) in accordo con Data Integrity. Questo permetterà all’utente di concentrarsi solo sulla qualità dei medicinali. Infine, la documentazione deve essere centralizzata, in modo che gli standard di qualità aziendali siano noti ed accessibili presso tutte le sedi, in qualsiasi parte del mondo. Questo significa che l’eQMS deve fornire strumenti di collaborazione come templates, task management, comunicazione (messagistica), definizione priorità, condivisione delle conoscenze.
TRAINING MANAGEMENT BASATO SU RUOLI
Il training è un requisito regolatorio e l’eQMS deve fornire un tool integrato di formazione strutturata e specifica per ruolo e qualifica del personale. Per ogni documento, procedura o altro oggetto si deve poter definire training necessario con tanto di quiz finale.
Una componente importante del training management è la reportistica automatica ed affidabile delle prestazioni di formazione, nonché la definizione delle metriche che permettono agli responsabili di monitorare lo stato e l’andamento generale e di evidenziare eventuali lacune nella formazione.
GESTIONE RECLAMI
Da non confondere con eventi avversi, per la registrazione e gestione dei quali esistono normative, procedure e sistemi dedicati.
La funzione di Gestione Reclami sarà utile soprattutto alle aziende Contract Developer e Contract Manufacturer e dovrà permettere la raccolta, classificazione e tracciatura dei reclami, in accordo alle GMP definite in 21 CFR parti 210 e 211.
Questo modulo deve essere abbastanza flessibile per poter essere adattato a qualsiasi realtà, processo e struttura del reclamo. Deve fornire strumenti di raccolta e analisi dei dati storici e produrre report statistici che permettono di misurare i miglioramenti nel tempo.
QUALITY EVENTS
Deviazioni, fuori specifiche, e non conformità. Questo tool è simile al precedente ma è destinato al solo uso interno ed è parte integrante del piano di miglioramento continuo. È fondamentale per le ispezioni poiché l’accuratezza con quali vengono registrati e tracciati gli eventi offre visibilità immediata sull’intero sistema di qualità aziendale.
Gli strumenti investigativi e decisionali, insieme all’integrazione fluida del tool nel ciclo globale, cioè la possibilità di convertire l’evento nell’azione successiva, sono componenti irrinunciabili. La raccolta automatica degli eventi, grazie all’integrazione con altri sistemi digitali aziendali, è un grande bonus.
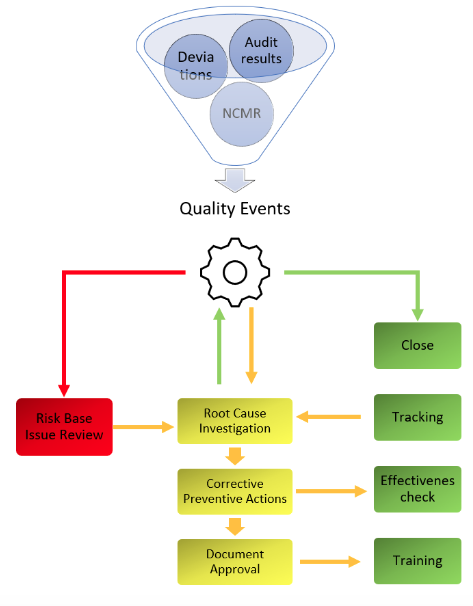
CAPA
Come conseguenza dei Quality Events, Le CAPA sono proposte, iniziative, azioni specifiche che vengono definite a valle di processo investigativo e mirano a mitigare le conseguenze (azioni correttive) o eliminare le cause dei problemi in modo che non accadono nel futuro (azioni preventive). Se le azioni definite diventano troppo complesse o se richiedono cambiamenti ai sistemi o processi validati, si procede all’apertura del Change Control.
CHANGE CONTROL
Il cambiamento è intrinseco del principio del miglioramento continuo, di conseguenza la funzione di Change Control è uno dei componenti chiave di un sistema di qualità a ciclo chiuso.
Come tale deve combinare diverse funzionalità come:
- raggruppamento di tutti gli oggetti impattati dal cambiamento come documenti, procedure, training, master batch record, mansionari, sistemi coinvolti, processi, fornitori, etc.
- piano delle attività (modifiche, studi di stabilità, test, etc) e assegnazione di queste al personale specifico
- strumento integrato di Risk-Assessment
- flusso approvativo, versioning
- il legame con i relativi Quality Events e risultati dell’investigazione
- Visibilità globale e monitoraggio dello stato di avanzamento del cambiamento
GESTIONE AUDIT & ISPEZIONI
Questo modulo è uno strumento fondamentale per la gestione efficiente del processo di ispezione, la registrazione e monitoraggio delle osservazioni e le conseguenti azioni correttive associate agli audit interni, nonché agli audit dei fornitori e alle ispezioni normative.
Le aziende subiscono numerosi audit durante l’anno. Moltiplicando questi per il numero di sistemi, documenti, processi e altri potenziali oggetti di ispezione ci si rende conto quale opportunità rappresenta un eQMS che fornisce accesso immediato a qualsiasi informazione ed evidenza del relativo stato di conformità.
GESTIONE FORNITORI
Tutti i fornitori, i loro sistemi, macchinari, software, prodotti e servizi devono soddisfare gli standard di qualità definiti dal cliente. Il modulo Supplier Management permette di gestire i processi di qualifica/audit, selezione e monitoraggio dei partner. Una volta qualificati i fornitori entrano a far parte del sistema di qualità dell’azienda e ad essi vengono applicati gli stessi processi visti sopra, compreso il monitoraggio delle performance e comunicazione tracciata. Spesso i fornitori devono seguire le procedure create dal cliente e dedicate a loro, per cui bisogna prevedere modalità di accesso specifiche al eQMS.
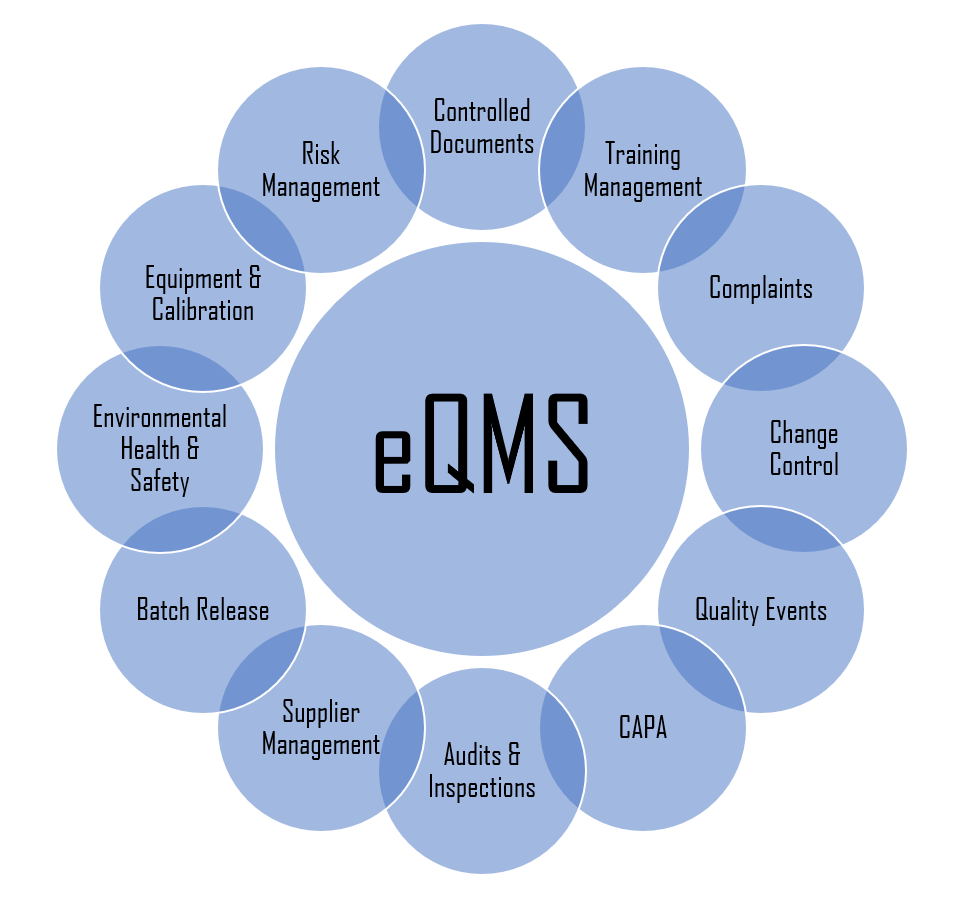
EQUIPMENT & CALIBRATIONS
Tutti i dispositivi, strumenti di analisi e sistemi di controllo ambientale dai quali dipende la qualità dei medicinali devono essere convalidati e di conseguenza devono essere costantemente controllati e calibrati nel rispetto delle normative. A seconda del tipo di dispositivo la modalità di manutenzione può cambiare. Tutte queste variabili, metodi, procedure e anagrafiche devono essere gestite dal eQMS in modo da aiutare l’azienda a pianificare le attività di manutenzione e a tenere gli asset aziendali sempre validati e pronti all’uso.
RISK MANAGEMENT
Miglioramento continuo significa cambiamento continuo. E ogni cambiamento è un rischio. Non solo, nell’industria di processo ci sono variabili e rischi da tenere sotto controllo anche durante l’esecuzione stessa dei processi convalidati. In altre parole, la qualità è soggetta a rischio continuo, per cui un eQMS moderno deve aiutare a identificare, valutare e gestire i rischi in tutti gli ambiti aziendali. Sono possibili due approcci:
– In qualunque momento poter identificare e documentare potenziali rischi per una specifica area/processo o quality record
– Eseguire un Risk-Assesment completo come una fase ben delineata del progetto
In entrambi i casi il registro dei rischi deve essere sempre accessibile per potere fare valutazioni mirate o globali, monitorare e tracciare tutti gli eventi annessi ai rischi elencati.
CONCLUSIONI
Il sistema di qualità farmaceutico è, dunque, l’ambiente più dinamico poiché deve tracciare i cambiamenti e miglioramenti continui di tutte le altre aree e reparti critici. È rivolto sia all’interno che all’esterno dell’azienda. È una “colla” che integra tutti i processi e accompagna il medicinale dalla fase di R&D, fino alla spedizione e talvolta fino alla somministrazione. Oltre a gestire i cambiamenti negli altri reparti, l’eQMS deve essere flessibile ed in grado di cambiare e adattarsi rapidamente a sua volta.
Visti questi requisiti, ecco altre proprietà universali che deve possedere un moderno eQMS:
- Estrema flessibilità nella definizione e modifica dei propri flussi di lavoro. Per esempio, attraverso designer di processi BPM o un Workflow manager.
- In generale una grande configurabilità dei processi, moduli, report, strutture dati e interfacce utenti
- Ottima capacità di integrazione con altri sistemi eterogenei
- Capacità di definizione di strutture organizzative articolate, ruoli e responsabilità
- Gestione avanzata degli accessi e delle autorizzazioni, basata sui ruoli
- Tool di analytics, trends e reportistica agile e facile da configurare e usare per poter aggregare e monitorare diverse tipologie di dati (training, test, deviazioni, SPC, etc)
- Strumenti di definizione degli obiettivi, monitoraggio delle KPI e presa di decisione basate sui fatti.
- Strumenti di comunicazione inter e intra aziendali
In passato, l’implementazione di tali sistemi richiedeva molte risorse e tempo. Oggi gran parte dell’entusiasmo per la gestione della qualità a ciclo chiuso deriva da progressi tecnologici relativamente recenti che hanno consentito alle organizzazioni a focalizzarsi sempre di più su ogni elemento del ciclo.
Visita il sito di Ympronta per saperne di più





