
Da un recente articolo di Ympronta: “Come cambia il concetto di Best Practices in un’epoca così dinamica come la nostra?”
Le prime Best Practices sulla gestione della qualità nelle organizzazioni farmaceutiche risalgono a quasi 100 anni fa. Il libro “The Principles of Scientific Management” dell’ingegnere Frederick Winslow Taylor, che ha fornito il primo approccio alla qualità nelle organizzazioni industriali, compreso l’uso di ispezioni e compiti chiaramente definiti, è stato scritto nel 1911.
Si potrebbe dire: “ma noi adottiamo le Best Practices più recenti“. Peccato che non esiste un ente regolatorio che periodicamente pubblica aggiornamenti sulle Best Practices. Nel mondo in cui l’unica cosa stabile è il cambiamento, come si fa a conciliare le novità con le best practices?
COSA SONO LE BEST PRACTICES?
Volendo usare un linguaggio semplice, le best practices dicono “fai come hanno fatto gli altri, se ha funzionato per loro funzionerà anche per te”. 10-15 anni fa questo approccio poteva andare bene, mentre oggi potrebbe essere un rischio. Vediamo il perché.
Innanzitutto, siamo sicuri che i processi di Qualità sono uguali in tutte le aziende? Noi crediamo che seguire le best practices è vantaggioso se:
- L’azienda adotta già i processi uguali a quelli delle cosiddette Best Practices. Cioè il suo percorso di standardizzazione è pressoché terminato.
- L’azienda vuole adottare i processi definiti dalle best practices, anche se i suoi processi attuali sono tutt’altro che standard. Questo è il caso in cui il management sceglie consapevolmente questo percorso estremo di standardizzazione supportato da un sistema “Best Practices”.
Naturalmente le due realtà, processi totalmente standard e processi totalmente personalizzati, sono i due estremi opposti e piuttosto rari. La verità è, come sempre, nel mezzo.
Quello che non ci torna è la parola “best”. Per chi queste practices sono best? “Best” è un giudizio assoluto… qualcosa che va bene per il 100% delle aziende.
La nostra filosofia sta nell’adottare l’approccio più adatto per ogni singolo cliente. Per la maggior parte delle aziende, infatti, la situazione non è omogenea: alcuni processi sono già standard, altri sono molto personalizzati.
Come si fa in questi casi?
Anche il concetto stesso delle Best Practices è interpretato spesso in modi diversi. E questa interpretazione cambia nel tempo e a seconda del contesto stesso. Vediamo alcuni esempi di queste interpretazioni:
- Best Practices che definiscono processi / funzionalità standard
- BP che descrivono migliori approcci di selezione o progettazione
- BP per Data Integrity, Data Governance e Cyber Security
- BP di terminologia (adozione di un linguaggio comune)
- BP che elencano gli ambiti di un sistema di qualità
Ma se ci pensiamo, la maggior parte dei fornitori di SW presenti sul mercato farmaceutico adotta queste Best Practices generali per definizione. In altre parole, per un SW farmaceutico queste BP sono un requisito necessario ma non sufficiente per essere incluso in una short list dei candidati.
Nel senso più ampio possiamo vedere le Best Practices come uno scambio di opinioni tra le aziende diverse che hanno problemi comuni. È sempre utile confrontarsi con altre realtà, imparando lezioni utili dalle loro esperienze. Ma anche se un’azienda deciderà di adottare qualche best practices, il suo percorso sarà comunque unico e irripetibile.

QUANTO È RISCHIOSO ADOTTARE LE BEST PRACTICES OBSOLETE?
Adottare le Best Practices significa, in sostanza, costringere l’azienda ad adattarsi alle regole più o meno recenti, definite da qualcun’altro.
Ma se si sbaglia a scegliere le best practices il rischio è quello di bloccare la crescita tecnologica dell’azienda o, nei casi peggiori, di regredire invece che evolvere.
Esiste, quindi, un modo di fare l’innovazione adottando le best practices?
FDA COME LA PENSA?
Dal momento che in gioco ci sono le vite umane, le aziende delle industrie regolamentate possono “agitarsi” quando si arriva all’adozione delle nuove tecnologie. Il fatto è che gli enti regolatori spingono le aziende ad adottare le nuove tecnologie negli ambiti che incrementano la stabilità, sicurezza e l’integrità dei dati.
Invece le aziende farmaceutiche non vedono l’ora di adottare anche le tecnologie che permettono di estrarre il valore dai loro dati, come l’Intelligenza Artificiale.
 Vista questa onda inarrestabile, la FDA stessa ha deciso di avviare un piano che mira a sviluppare le nuove normative proprio per agevolare l’adozione delle tecnologie basate sull’uso dei dati (IA, ML) anche nelle aziende Life Science. Il piano in questione, Data Modernization Action Plan (DMAP), per ora è solo un piano, e le normative sono ancora “Work in progress”. Speriamo di vedere presto i primi risultati e di conoscere le nuove Good Machine Learning Practices (GMLPs).
Vista questa onda inarrestabile, la FDA stessa ha deciso di avviare un piano che mira a sviluppare le nuove normative proprio per agevolare l’adozione delle tecnologie basate sull’uso dei dati (IA, ML) anche nelle aziende Life Science. Il piano in questione, Data Modernization Action Plan (DMAP), per ora è solo un piano, e le normative sono ancora “Work in progress”. Speriamo di vedere presto i primi risultati e di conoscere le nuove Good Machine Learning Practices (GMLPs).
E dal momento che i dati oggettivi sono “la causa” principale delle decisioni che portano ai cambiamenti dei processi, queste nuove normative necessariamente tratteranno anche il tema del Change Management.
Sfruttare i dati per migliorare (cioè cambiare) continuamente i processi, significa impatto potenziale sulla convalida degli stessi. E i fornitori di SW, che hanno intuito questo trend molto prima dell’FDA, fanno da tempo la gara a chi per primo creerà un software altamente configurabile che ha impatti bassi sulla convalida.
LA SQUADRA VINCENTE… SI CAMBIA!
 Nell’ambito informatico esiste una espressione analoga: “Il software che funziona è obsoleto”. Noi conosciamo solo i software e prodotti che hanno avuto successo, ma non conosceremo mai i progetti e le idee che non sono riuscite ad affermarsi sul mercato. I motivi possono essere diversi ma su uno di questi è difficile dubitare: se un prodotto ha avuto successo significa che alla base ci è stata una forte componente di innovazione. Questa condizione, cioè la continua innovazione, è necessaria non solo per creare un buon software, ma anche per mantenere le quote di mercato guadagnate. Per questo motivo, nel momento in cui esce una nuova versione di un buon SW, i team di sviluppo sono già da tempo al lavoro alla versione successiva.
Nell’ambito informatico esiste una espressione analoga: “Il software che funziona è obsoleto”. Noi conosciamo solo i software e prodotti che hanno avuto successo, ma non conosceremo mai i progetti e le idee che non sono riuscite ad affermarsi sul mercato. I motivi possono essere diversi ma su uno di questi è difficile dubitare: se un prodotto ha avuto successo significa che alla base ci è stata una forte componente di innovazione. Questa condizione, cioè la continua innovazione, è necessaria non solo per creare un buon software, ma anche per mantenere le quote di mercato guadagnate. Per questo motivo, nel momento in cui esce una nuova versione di un buon SW, i team di sviluppo sono già da tempo al lavoro alla versione successiva.
Purtroppo, nell’industria farmaceutica esiste la “piaga” che impedisce di innovare troppo spesso, il cui nome è Computer System Validation. Ed è per questo che il settore Pharma è tra gli ultimi nel viaggio della digitalizzazione.
| Quindi potremmo dire che la vera Best Practices per un SW farmaceutico è la sua capacità di adattarsi rapidamente alle nuove esigenze senza impattare troppo sulla convalida! |
Questo vale ancor di più per i software eQMS perché, oltre a fare il loro compito, quello di gestire i cambiamenti in altri reparti, devono, a loro volta, cambiare agilmente, arrivando ad avere padronanza completa del cambiamento.
Ovviamente per essere padroni del cambiamento bisogna saperlo vedere arrivare, e i cambiamenti possono arrivare da qualsiasi direzione: dall’esterno (clienti, concorrenza, nuove normative, nuove tecnologie…) ma anche dall’interno (dati, connettività, ciclo di Deming…)
Ma come è possibile raggiungere tutto questo senza provocare enormi impatti sulla convalida?
ADDIO CONVALIDA… ?
Non vogliamo certo rivelare nessuna novità o segreto. Le GAMP (Good Automated Manufacturing Practice) esistono da 30 anni e ad oggi sono arrivate alla versione 5 e descrivono le 5 categorie di software ed il relativo approccio alla convalida.
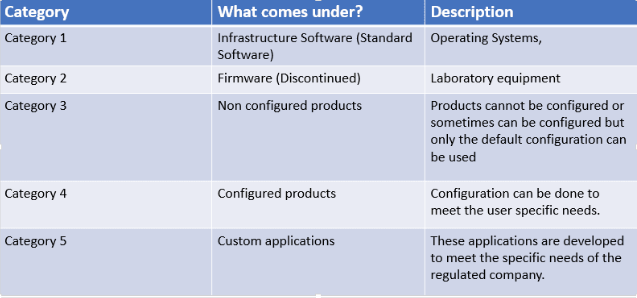
Di queste ci interessano maggiormente le ultime 2 categorie.
Category 5:
Partiamo da questa poiché, in termini cronologici, sono software “classici” e più facili da comprendere. Si tratta di applicazioni (o parti di esse) sviluppate appositamente per soddisfare richieste specifiche del cliente. Essendo totalmente nuovi e personalizzati, questi software devono essere sottoposti ad una convalida completa (FAT, SAT, IQ, OQ, etc.). La profondità ed il dettaglio di questa convalida saranno determinati dall’impatto GMP che il software in questione comporta.
Category 4:
Software configurabili: il sistema viene fornito con una serie di moduli, funzionalità e processi pronti all’uso (le famose Best Practices), il che significa testati, documentati e pre-convalidati. A questi si aggiungono funzionalità configurate che coprono processi specifici del cliente che non erano inclusi nel modello predefinito.
Per i software GAMP di categoria 4, l’approccio alla convalida può essere quello di utilizzare la documentazione e i test del fornitore per dimostrare l’idoneità dei moduli standard, e limitare le verifiche aggiuntive alle sole funzioni critiche e alle funzioni relative alla conformità normativa (sicurezza, firme elettroniche, audit trail, etc.).
Un bel vantaggio!
Qual è la novità, dunque? Più è avanzato il software, più è configurabile, e quindi minore è lo sforzo da dedicare alla convalida. E la novità sta nel fatto che, grazie alle nuove tecnologie, nascono software eQMS che permettono di coprire processi cliente sempre più personalizzati con la sola configurazione.
| In altre parole, si possono ottenere gli stessi vantaggi offerti dall’adozione delle Best Practices senza irrigidire l’azienda e senza “copiare” quello che hanno fatto gli altri. |
Naturalmente nessun software sarà mai configurabile al 100%. D’altro canto tutti i software attualmente in circolazione sono parzialmente configurabili. La sfida, dunque, è trovare il software con la quota di configurabilità più alta.
CONCLUSIONI
Il messaggio principale che vogliamo dare è quello di non buttarsi su una soluzione / fornitore solo perché promette di implementare le Best Practices. Prima di tutto è necessario valutare quanto la vostra azienda sia lontana dal cosiddetto standard.
Le stesse GMP (Good Manufacturing Practice), pubblicate ed aggiornate dagli enti regolatori, non sono degli standard prescrittivi su come fabbricare i medicinali. Sono dei requisiti che bisogna soddisfare durante la produzione. Ma i modi in cui questi requisiti possano essere coperti sono tantissimi. Per cui è la responsabilità di ogni azienda trovare ed implementare il modo migliore e più efficiente per rispettare le normative regolatorie.
Quella di adottare o meno le Best Practices, deve essere una scelta consapevole, basata su analisi approfondita della propria realtà e sul confronto di questa con l’esperienza delle altre aziende. L’approccio “se ha funzionato per gli altri funzionerà anche per noi” sperando di risparmiare risorse preziose durante la selezione potrebbe non essere vincente. I risparmi del tempo e denaro ottenuti grazie alla selezione basata esclusivamente sulle Best Practices, potrebbero essere persi già nei primi mesi di utilizzo del eQMS, qualora la scelta si rivelasse sbagliata.
Visita il sito di Ympronta per saperne di più





